Philippe Mauclet
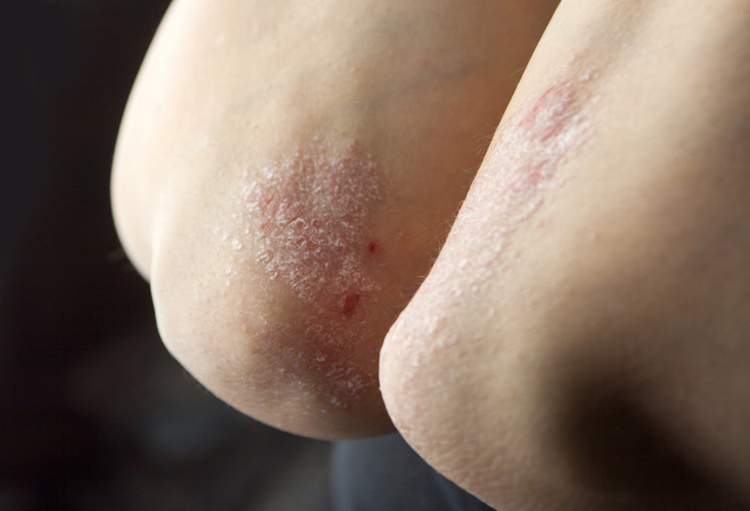
L’ixékizumab, un anticorps monoclonal anti-IL 17A, est utilisé et approuvé dans le traitement du psoriasis en plaques modéré à sévère de l’adulte. Une étude de phase III illustre sa supériorité par rapport au placebo en termes de bénéfice clinique et de qualité de vie, chez l’enfant et l’adolescent.
Ixékizumab versus placebo…versus étanercept
Comme l’a précisé Kim Papp (Toronto, Canada), cette étude randomisée et en double aveugle a inclus des sujets âgés de 6 à 18 ans avec un PASI (Psoriasis Area and Severity Index) ≥ 12, un sPGA (static Physician’s Global Assessment) ≥ 3 et un BSAI (Body Surface Area Involvement) ≥ 10%. Ces sujets étaient candidats à la photothérapie ou à un traitement systémique et n’étaient pas contrôlés de manière adéquate par un traitement topique.
Ils ont été traités par ixékizumab toutes les 4 semaines (n = 115) ou ont reçu un placebo (n = 56). La dose d’ixékizumab était définie en fonction du poids corporel. Le critère principal d’évaluation était double et comprenait le taux de patients avec PASI 75 et sPGA = 0,1 à la semaine 12. Les pourcentages de patients avec PASI 90, PASI 100 et sPGA = 0 figuraient parmi les critères secondaires.
Dans les pays où l’étanercept est approuvé dans le traitement du psoriasis sévère de l’enfant, les patients ont été randomisés en 3 groupes – ixékizumab (n = 38, double aveugle), étanercept (n = 30, open label) ou placebo (n = 19, double aveugle) – selon un ratio 2, 2 et 1. À la semaine 12, les patients sont entrés dans une phase ouverte (apres un wash out period pour les patients sur etanercept), puis dans une phase d’extension. Les résultats présentés à Madrid concernent l’efficacité jusqu’ à la semaine 12 et la sécurité à plus long terme, c’est-à-dire au cours d’une période incluant la phase de maintenance et d’extension.
Une amélioration significative en termes de PASI, et de sPGA, de prurit et de qualité de vie
Les résultats sont en faveur de l’ixékizumab, avec des taux de PASI 75, 90 et 100 de respectivement 89%, 78% et 50%, versus 25%, 5% et 2% dans le groupe placebo (p < 0,001). Pour le sPGA (0,1) et pour le sPGA (0), les pourcentages étaient de respectivement 81% versus 11% (p < 0,001) et de 52% versus 2% (p < 0,001).
Pour la population randomisée en 3 groupes, les taux de PASI 75 à 12 semaines étaient respectivement de 84% pour l’ixékizumab, de 63% pour l’étanercept et de 26% pour le placebo. Pour le sPGA (0,1), ils étaient de 76%, 53% et 5%.
L’amélioration en termes de prurit (augmentation d’au moins 4 points sur l’échelle NRS [itch numeric rating scale]) et de qualité de vie (score de 0 ou 1 sur l’échelle CDLQI chez les moins de 16 ans, sur l’échelle DLQI chez les sujets de 17 ans ou plus) était également plus marquée dans le bras ixékizumab: les taux étaient de 71% versus 20% pour l’amélioration du prurit (p < 0,001), et de 64% versus 23% pour le gain en qualité de vie (p < 0,001).
Des effets indésirables légers à modérés, sans événement inattendu
Les taux d’effets indésirables à la semaine 12 ont été de 45% dans le groupe placebo et de 43% dans le groupe étanercept et de 56% dans le groupe ixékizumab. Aucun effet indésirable ne s’est révélé sévère pour ixekizumab, et aucun événement inattendu n’a été observé. L’effet indésirable le plus fréquemment observé sous ixékizumab a été la réaction au site d’injection, observée dans 12% des cas au cours de la phase randomisée et 20% pour la période incluant phase randomisée et extension.