L’application d’un écran solaire d’indice 50+ diminue la production de vitamine D cutanée de manière significative après une seule exposition aux UVB, indépendamment de la surface corporelle exposée.
En revanche, les taux de 25-hydroxyvitamine D circulants ne sont que légèrement affectés. Il est probable qu’une source endogène alternative en vitamine D3 soit privilégiée lorsque sa synthèse cutanée est bloquée par l’application d’un filtre solaire.
Introduction
La vitamine D est bien connue pour ses effets bénéfiques sur l’homéostasie phosphocalcique. La découverte de son rôle dans différentes pathologies et de son implication dans la prévention de cancers, d’infections, de maladies cardiovasculaires ou encore de pathologies auto-immunes a favorisé l’intérêt pour cette molécule.
La vitamine D trouve sa source, pour plus de 90%, dans la synthèse cutanée, les 10% restants provenant de l’alimentation. Brièvement, la vitamine D3 est synthétisée dans l’épiderme sous l’action des radiations ultraviolettes de type B (UVB) à partir d’un précurseur dénommé 7-déhydrocholestérol (7-DHC).
La vitamine D3 rejoint le foie pour y être, sous l’action de la 25-hydroxylase, convertie en 25-hydroxyvitamine D [25(OH)D], qui est la forme «circulante». Elle est ensuite transportée au niveau du rein pour subir une deuxième hydroxylation par la 1,25 hydroxylase et devenir la 1,25(OH)2D, qui est la forme «active» de la vitamine D.
La photoprotection est essentielle dans la prise en charge des cancers cutanés et des dermatoses photosensibles. Étant donné que la 25(OH)D provient pour plus de 90% de la production cutanée, les différentes mesures de photoprotection induisent, par définition, une diminution des taux sériques en vitamine D.
Les effets des écrans solaires de première génération [Sun Protection Factor (SPF) 10-15] sur la production de vitamine D restent controversés: certains auteurs ont trouvé une inhibition significative de sa production (1-5), tandis que d’autres ne relèvent aucune influence des crèmes solaires sur la vitamine D (6-13). D’autres encore ont même conclu, à l’inverse, en une corrélation positive entre l’application de crème solaire et les valeurs de 25(OH)D (6). Par conséquent, l’influence précise des écrans solaires sur la production de vitamine D3 et de 25(OH)D reste à déterminer.
Cette étude a évalué l’effet d’un écran solaire 50+ sur la production cutanée de vitamine D3 et sur les taux sériques de 25(OH)D en fonction de différentes zones de surface corporelle (Body Surface Area – BSA) exposées, correspondant aux habitudes vestimentaires courantes, après une exposition UVB. Dans une étude précédente, différents niveaux de production de vitamine D3 et de 25(OH)D ont été mis en évidence en fonction de la surface corporelle exposée aux UVB (14).
Matériels et méthodes
Cette étude a été réalisée conformément à la Déclaration d’Helsinki (15) et a été approuvée par le comité d’éthique de l’hôpital universitaire. Tous les participants ont signé un formulaire de consentement éclairé.
Volontaires
72 volontaires (hommes: 25; femmes: 47), d’un âge moyen de 23,0 ± 2,3 ans (min.: 19; max.: 25), avec un IMC de 21,6 ± 1,9kg/m2 (min.: 18; max.: 25) et un phototype III selon la classification de Fitzpatrick, ont été recrutés parmi les étudiants en médecine. Les critères d’exclusion étaient les suivants: supplémentation en vitamine D par voie orale, âge < 18 ans ou > 25 ans, IMC < 18 ou > 25, apport(s) alimentaire(s) en vitamine D, immunosuppression, prise de médicaments photosensibilisants, contexte de maladie photosensibilisante, insuffisance hépatique, PUVA ou UVB thérapie, vacances récentes au soleil ou séance de solarium moins de 1 mois avant le début de l’étude.
Dose érythémateuse minimale
La détermination de la dose érythémateuse minimale (DEM) a été effectuée chez tous les volontaires en utilisant un Gigatest UVB (lampe Philips TL01, d’une longueur d’onde 310-315nm, avec un pic à 311nm). Les 5 fenêtres de l’appareil présentent une ouverture de 15mm de diamètre et transmettent les UVB de façon croissante, entre 7% et 100% selon le filtre. La lecture a été réalisée après 24 heures.
Irradiation UVB
Les sujets ont reçu une seule dose d’exposition aux UVB à spectre étroit (Waldmann, 311-313nm, 0,003W/cm2), correspondant à 0,8 DEM (afin d’éviter un érythème) de chaque volontaire (moyenne: 0,22 ± 0,08J/cm2).
Crème solaire
La crème utilisée était un lait de SPF 50+ avec une densité de 1 comportant des absorbants chimiques dans le rang de la longueur d’onde des UVB (290-320nm), des UVA2 et des UVA1 (320-340 et 340-400nm, respectivement). La quantité de crème solaire a été calculée pour correspondre à 2mg/cm2 pour chaque surface exposée.
Surface corporelle exposée
Les sujets ont été divisés au hasard en 4 groupes de 15 sujets avec différentes surfaces corporelles à exposer aux UVB, et 1 groupe de 12 sujets a servi de contrôle. Les surfaces corporelles ont été déterminées selon les habitudes vestimentaires de la vie courante:
- groupe I (n = 15): tête, nuque et mains (BSA = 9%);
- groupe II (n = 15): tête, nuque, bras et mains (BSA = 23%);
- groupe III (n = 15): tête, nuque, bras, mains, jambes et pieds (BSA = 50%);
- groupe IV (n = 15): corps entier (BSA = 96%);
- groupe contrôle (ou groupe V) non exposé (n = 12).
Les pourcentages de surface corporelle ont été calculés selon la règle de Wallace (16).
Analyses de la vitamine D
Les niveaux de vitamine D3 et de 25(OH)D ont été déterminés en utilisant la chromatographie en phase liquide couplée à la spectrométrie de masse (LC-MS/MS) (17).
Statistiques
Les statistiques ont été exprimées en moyenne et écart-type pour les variables continues et en tables de fréquence pour les variables catégoriques. Sur les graphiques, les valeurs moyennes ont été tracées avec leur erreur standard. Le modèle mixte linéaire général a été utilisé pour analyser les évolutions de la vitamine D3 et de la 25(OH)D au fil du temps, et testé pour les différences de groupe. Une régression linéaire a été utilisée pour comparer l’aire sous la courbe (ASC) de vitamine D et de 25(OH)D par rapport à la BSA. Les résultats ont été considérés comme significatifs au niveau critique de 5% (p < 0,05).
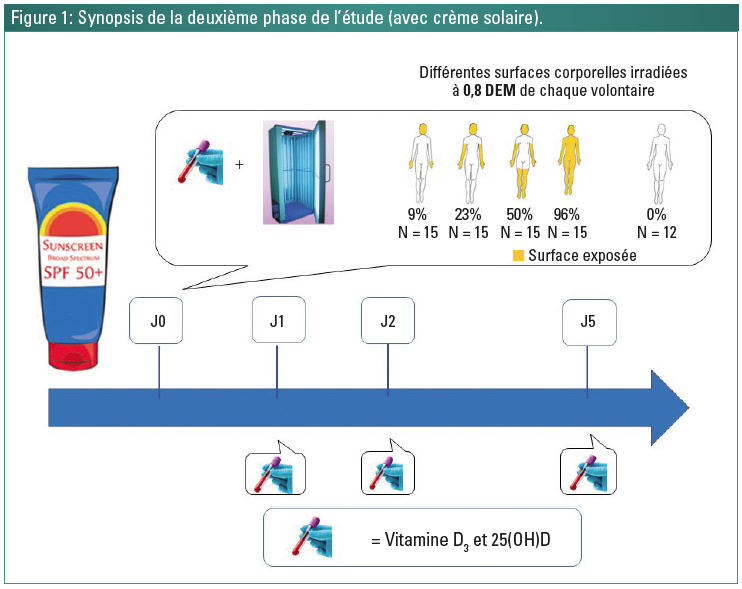
Synopsis de l’étude
Au jour -1, le dispositif Gigatest a été appliqué chez tous les sujets pour déterminer leur DEM dans les 4 groupes d’étude. Au jour 0, l’évaluation de la DEM a été effectuée pour chaque individu, et un échantillon de sang a été prélevé pour déterminer les taux de base en vitamine D3 et en 25(OH)D. Par la suite, les 4 groupes ont été exposés à une irradiation unique UVB de 0,8 fois leur DEM. Des échantillons de sang ont été prélevés aux jours 1, 2 et 5. Le groupe V (n = 12) a servi de groupe témoin non exposé. Un mois plus tard, correspondant à une période de wash-out pour la 25 (OH)D, le même protocole a été appliqué, avec comme seule différence que les sujets ont été invités à appliquer la protection solaire SPF 50+ avant l’exposition UVB (Figure 1). Le principal critère d’évaluation était l’ASC exprimée en pourcentage de production cutanée de vitamine D3 et de 25(OH)D par groupe avec et sans crème.
Résultats
Sans crème solaire, la vitamine D3 a atteint un niveau maximal au jour 1 pour les groupes I et II et au jour 2 pour les groupes III et IV. Elle a diminué par la suite dans tous les groupes, sauf dans le groupe témoin, où aucune variation n’a été constatée (Figure 2) (14). Les ASC ont progressivement augmenté pour les niveaux de vitamine D3 dans les groupes I à IV, mais pas dans le groupe contrôle (Tableau 1) (Figure 2). La 25(OH)D a augmenté régulièrement à tous les temps dans tous les groupes, mais pas dans le groupe contrôle. Une augmentation constante de l’ASC a également été constatée pour la 25(OH)D (Tableau 1) (Figure 2). Pour la vitamine D3 et la 25(OH)D, plus la zone exposée était grande (groupe IV > III > II > I), plus l’augmentation était importante.
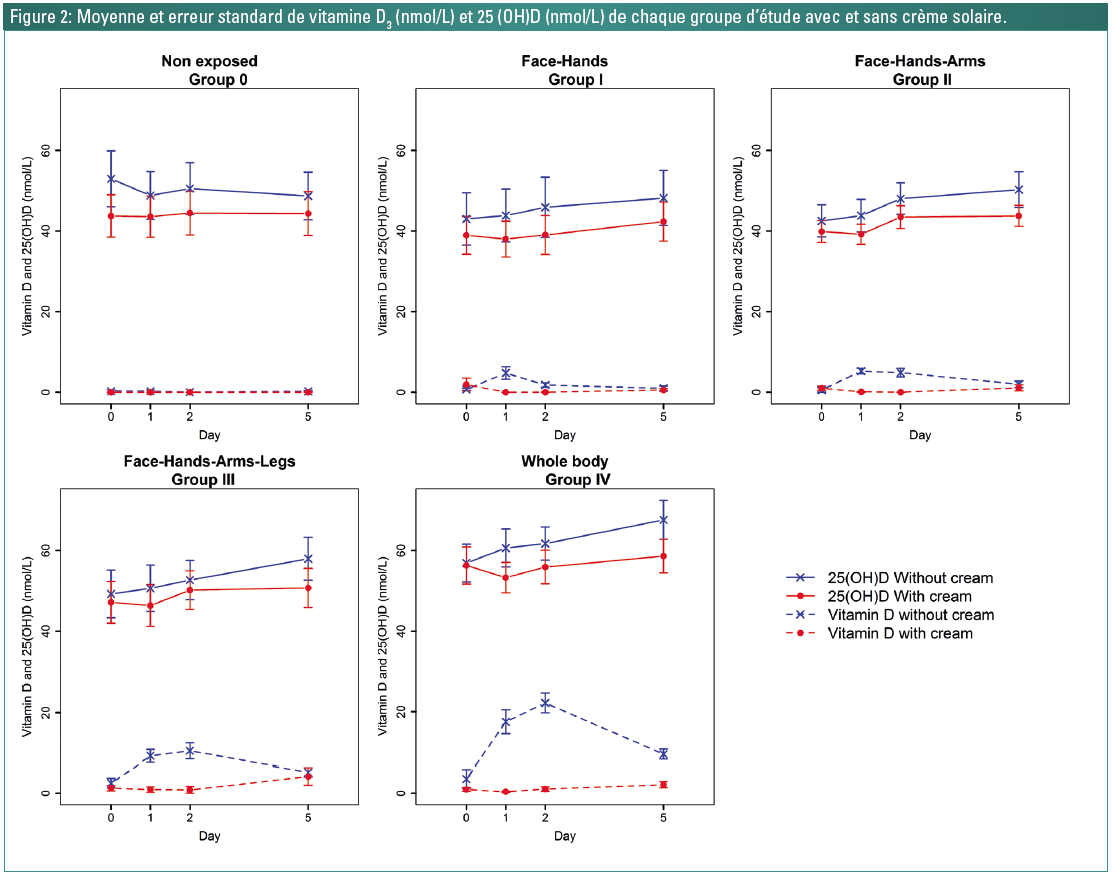
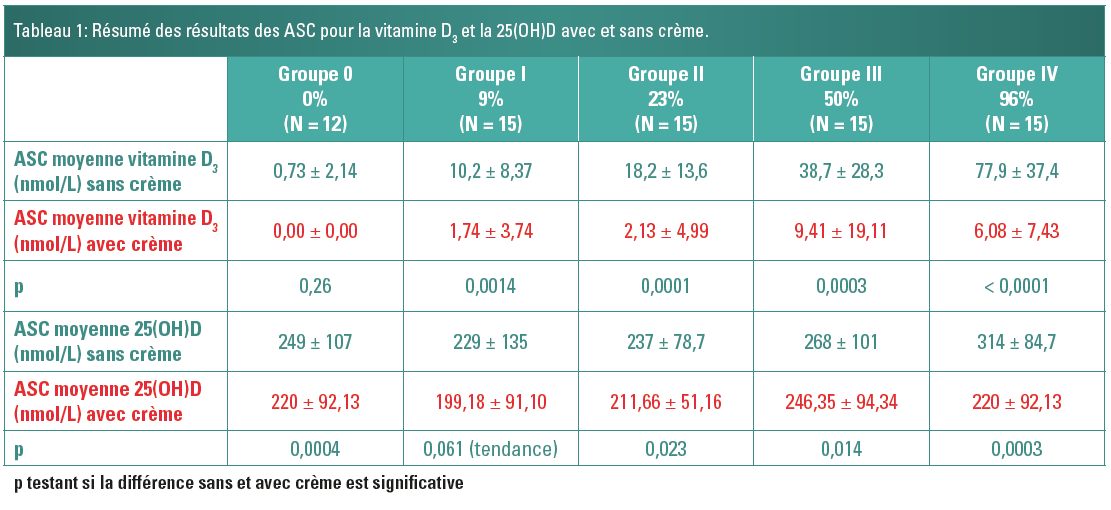
Avec l’écran solaire, la vitamine D3 n’a pas augmenté entre le jour 0 et le jour 5 dans les groupes I à IV. Ces différences par rapport à l’absence d’application de crème solaire se sont révélées statistiquement significatives (Tableau 1). Les valeurs d’ASC pour la 25(OH)D, comparées à l’absence d’application de crème solaire, se sont révélées de nouveau statistiquement significatives (Tableau 1). Pour la vitamine D3, il y a une abolition de la production dans chaque groupe avec crème, excepté pour le groupe contrôle, tandis que pour la 25(OH)D, on constate que la production est diminuée mais que la cinétique de production reste conservée.
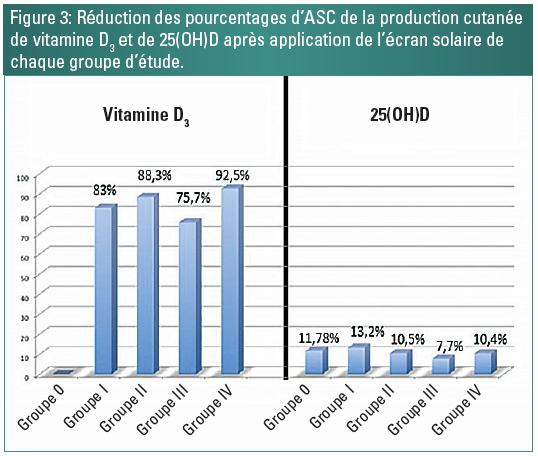
Exprimée en pourcentage de réduction d’ASC, l’utilisation de la protection solaire a diminué la production cutanée de vitamine D3 de 83%, 88,3%, 75,7% et 92,5%, mais seulement de 13,2%, 10,5%, 7,7% et 10,4% pour les valeurs de 25(OH)D (Figure 3), respectivement dans les groupes I à IV.
Discussion
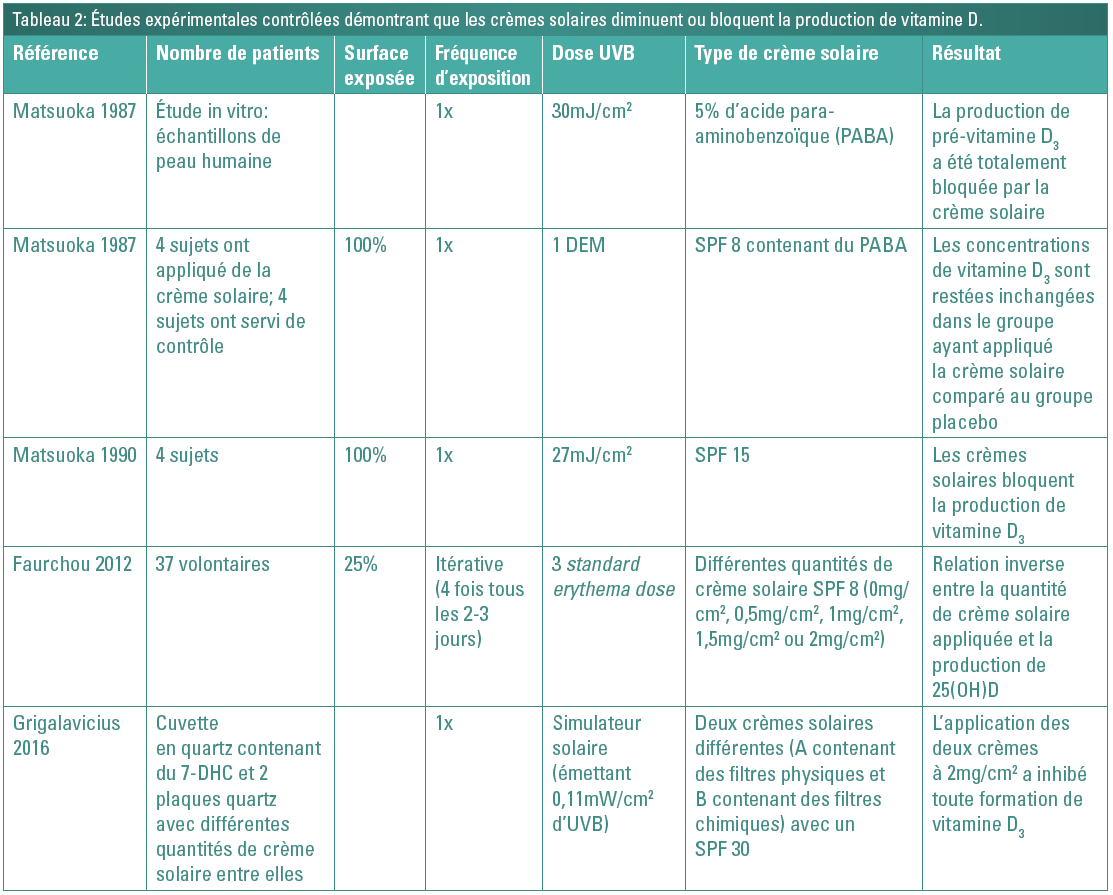
L’influence des écrans solaires sur la production de vitamine D reste débattue. Les études cliniques et in vitro ayant utilisé une application contrôlée de crème solaire ont montré une inhibition ou un blocage complet de la production cutanée de vitamine D (1, 2, 18) et des niveaux circulants de 25(OH)D (5) (Tableau 2). Certains auteurs considèrent même l’utilisation des protections solaires comme facteur de risque de mélanome, de lymphome, ainsi que de cancer du sein et de cancer colorectal via le déficit en vitamine D qui résulte de la photoprotection (8).
En revanche, les situations de «vie réelle» montrent que les niveaux de vitamine D ne sont pas affectés par l’utilisation de crèmes solaires. Une étude australienne a révélé que l’application régulière d’un filtre solaire (SPF 17) pendant une période de 7 mois n’a pas influencé les niveaux de 25(OH)D (8). Certains auteurs ont même montré une corrélation positive entre l’application de la protection solaire et les valeurs de 25(OH)D (6, 9, 12), alors que d’autres n’ont trouvé aucune relation entre ces deux variables (4, 7, 10). De plus, aucune différence significative dans la réduction de la masse osseuse et la concentration relative de 25(OH)D n’a été observée après une application d’une crème solaire d’indice 15 par rapport à l’application d’un placebo pendant 2 années consécutives (19). Ces résultats pourraient s’expliquer par plusieurs faits: les écrans solaires peuvent inciter les individus à une exposition plus fréquente et prolongée au soleil (8-10, 20), la quantité de crème solaire spontanément appliquée sur la peau est habituellement inférieure aux quantités recommandées (7, 16), et le blocage total des UVB par des écrans solaires n’est probablement jamais obtenu (8). En outre, il convient de rappeler que les indices solaires appliqués dans toutes ces études étaient beaucoup plus faibles que les écrans solaires SPF 50+ actuellement disponibles (21).
La crème solaire «optimale» devrait fournir une protection suffisante contre l’érythème provoqué par le soleil sans affecter la production cutanée de vitamine D. Malheureusement, le pic de la longueur d’onde responsable de l’érythème se situe à 308nm, tandis que la synthèse cutanée de la vitamine D a quant à elle un pic à 297nm: il y a donc un chevauchement partiel des deux spectres (22, 23). Par conséquent, des chercheurs tentent de surmonter ce problème (23).
Bien que nous ayons objectivé une diminution d’environ 10% de 25(OH)D dans tous les groupes, les résultats obtenus pourraient traduire la biovariabilité des niveaux de 25(OH)D (24). Un relargage de vitamine D3 à partir d’un réservoir comme le tissu adipeux est également possible en cas d’absence de synthèse cutanée de vitamine D (25). De plus, cette étude révèle que l’augmentation en vitamine D3 atteint son maximum 24 heures après l’exposition dans les groupes I et II, tandis que le pic est obtenu à 48 heures pour les groupes III et IV. Ceci est en phase avec le fait que les sites couramment exposés au soleil comme la face et les mains (groupe I) sont des producteurs plus puissants de vitamine D3 (14) et peuvent être associés à une vitesse de production en vitamine D plus élevée.
Conclusion
La production cutanée de vitamine D induite par une irradiation UVB à spectre étroit est bloquée en utilisant un écran solaire SPF 50+, indépendamment de la surface exposée, mais les niveaux circulants de 25(OH)D ne sont pratiquement pas affectés. L’utilisation à court terme de crème solaire n’a probablement pas d’incidence sur les niveaux circulants de vitamine D et ne constitue donc pas un risque accru d’ostéoporose. L’effet de l’utilisation de crèmes solaires au long cours reste cependant à déterminer.